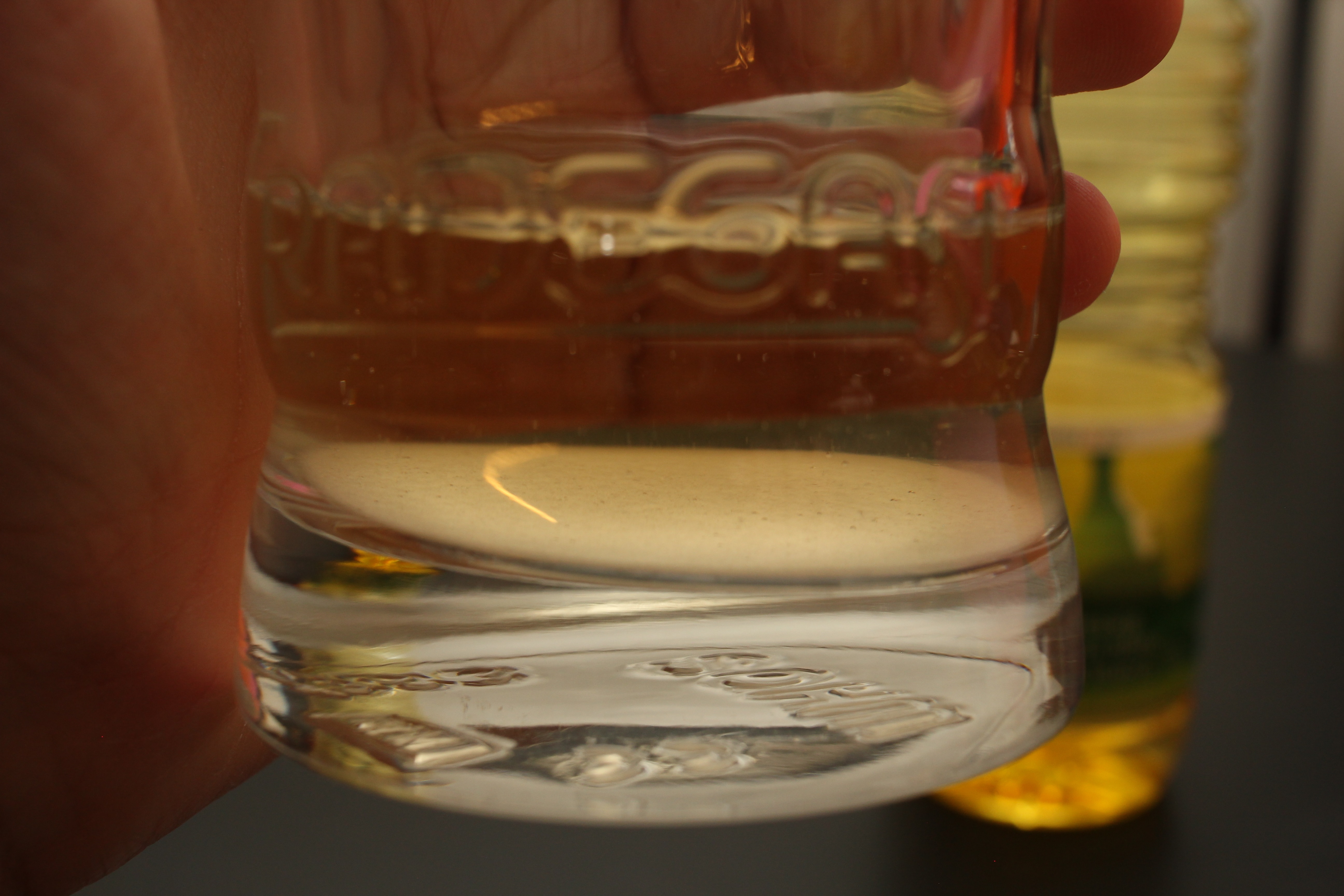Accueil > Nos actions > Références & Support > Supports Pédagogiques & Techniques > Utiliser le vinaigre et le bicarbonate pour introduire les réactions chimiques
Je m'inscris
Ajouter à ma liste de souhait
Introduction
Beaucoup d’enfants le savent, le bicarbonate de soude (ou « levure chimique », ou encore bicarbonate de sodium), lorsqu’il est mélangé avec le vinaigre ou le citron, donne très rapidement une sorte de mousse blanche. Mais que se passe-t-il vraiment ? Et comment utiliser cette réaction pour introduire les concepts de chimie tels que « réactif limitant » ou « réaction totale » ? C’est ce que je vous propose de découvrir dans cet article.
Le Projet
Introduction à la chimie de la réaction
Largement utilisé en cuisine et en nettoyage, le vinaigre est un liquide majoritairement composé d’eau et d’acide éthanoïque. Ce dernier aussi appelé « acide acétique ». De formule brute ![]() , voici sa structure chimique :
, voici sa structure chimique :
Il fait partie de la catégorie des acides organiques. Un acide, plus généralement, est une espèce chimique susceptible de céder des ions ![]() . C’est le cas de cette molécule, qui réagit avec l’eau pour former l’ion ethanolate et l’ion
. C’est le cas de cette molécule, qui réagit avec l’eau pour former l’ion ethanolate et l’ion ![]() :
:
(1) ![]() ->
-> ![]()
Les composés organiques étant majoritairement composés de carbone C et d’hydrogène H, l’acide éthanoïque est donc effectivement un acide organique. Ce sont par ailleurs ses propriétés acides qui font de lui un bon nettoyant.
Le bicarbonate de sodium est quant à lui une poudre blanche de composition ![]() . Dans l’eau, ces composés se dissocient respectivement en ion sodium et en ion hydrogénocarbonate :
. Dans l’eau, ces composés se dissocient respectivement en ion sodium et en ion hydrogénocarbonate :
(2) ![]() ->
-> ![]()
Comme l’acide éthanoïque, l’ion hydrogénocarbonate est un acide, qui peut donc relâcher un ion ![]() :
:
(3) ![]() ->
-> ![]()
Cependant, lorsque l’on est en milieu acide, cet ion peut également absorber un ion ![]() , c’est donc aussi ce que l’on appelle une base, l’opposé d’un acide :
, c’est donc aussi ce que l’on appelle une base, l’opposé d’un acide :
(4) ![]() ->
-> ![]()
Et ce dernier composé peut enfin se dissocier en « eau + dioxyde de carbone » de la manière suivante :
(5) ![]() ->
-> ![]()
Lorsque vinaigre et levure chimique sont mis en présence, nous pouvons ainsi observer la réaction suivante, issue des équations numérotées 1 à 5 :
(6) ![]() ->
-> ![]()
L’acide éthanoïque et le bicarbonate de soude réagissent donc ensemble et laissent place, en particulier, à l’ion ethanolate et du dioxyde de carbone. Cette réaction chimique est ce que l’on appelle un équilibre, car lorsqu’ils sont mis en présence et laissés pendant un temps suffisant, l’on aura en tout temps tous les réactifs et tous les produits, « en équilibre », donc. Or, le dioxyde de carbone est un gaz : loin de vouloir rester dissous dans le liquide (« en solution »), il passe dans l’air et disparaît. Cela force alors la génération des produits, et ainsi la consommation des réactifs « jusqu’au dernier combattant ». Il s’agit donc, en première approximation, d’une réaction totale. Ainsi, plus l’on aura de réactifs, plus il y aura de produits. Et si l’un des réactifs est en défaut (en-dessous du ratio 1:1 dicté par l’équation 6), alors c’est celui-ci qui limite la quantité de produits formés, et l’on parle alors de réactif limitant.
Réaction chimique, réactifs, produits, réaction totale et réactif limitant sont tous des concepts cruciaux en chimie, et il serait donc dommage de ne pas les introduire de manière amusante.
Ça mousse !
Matériel nécessaire : bicarbonate de soude, vinaigre, un verre, une cuillère
a) Une réaction totale
Visuellement, cette réaction produit un gaz à partir de vinaigre et d’une poudre. Si l’on verse juste un peu de poudre dans un verre de vinaigre, que se passe-t-il ?
L’on observe de la mousse, et après quelques secondes la poudre blanche a disparu. Et si l’on renifle, le mélange sent toujours le vinaigre. La réaction chimique a donc totalement consommé notre poudre, sans pour autant consommer tout l’acide éthanoïque, c’est donc une « réaction totale » dont les « réactifs » sont le vinaigre et le bincarbonate.
b) Le réactif limitant
Maintenant, ajoutons de la poudre supplémentaire : au bout d’une certaine quantité, l’on n’observe plus de mousse, et si l’on renifle, cela ne sent plus le vinaigre. Les deux réactifs ont donc été tout deux consommés. Et si l’on ajoute suffisamment de bicarbonate de soude, l’on pourra voir cette poudre s’accumuler au fond du verre. En effet, il n’y a plus assez de vinaigre pour consommer tout le bicarbonate, et il s’accumule donc dans le fond du verre. Et lorsque l’un des réactifs fait défaut à la réaction chimique, celui-ci est appelé le « réactif limitant ».
Ça gonfle !
Matériel nécessaire : quelques bouteilles de soda en verre transparentes, autant de ballons de baudruche, du bicarbonate de soude, une cuillère à café et du vinaigre.
Un entonnoir ou un bout de papier peuvent aider à verser la poudre dans les ballons.
a) Préparation
A l’aide d’un bout de papier, mettre dans un premier ballon une cuillère à café bien rase de bicarbonate de soude. Dans un deuxième ballon, mettre le double, puis encore le double dans le troisième ballon, et ainsi de suite.
Remplir plus ou moins à ras bord les bouteilles avec le vinaigre.
Un par un, placer les ballons de baudruche remplis de poudre de façon à fermer la bouteille, en prenant garde de ne pas verser de poudre avant que l’ensemble soit hermétique.
b) Action !
Basculer les ballons et les observer se gonfler tout seuls. Veiller à ce que le ballon ne s’échappe pas ! Il ne faut pas hésiter à faire passer le contenu de la bouteille dans le ballon pour bien mélanger poudre et liquide.
c) Explication et mesure
Les ballons se remplissent de dioxyde de carbone, le seul produit gazeux de cette réaction chimique, celui-là même qui provoque la mousse préalablement observée. L’on peut également voir que plus les ballons étaient remplis de poudre, et plus ils sont remplis de gaz. Mais au-delà d’une certaine quantité, le volume de gaz n’augmente plus : c’est désormais l’acide éthanoïque du vinaigre qui est le réactif limitant. Et puisque chacune des bouteilles était remplie, le gaz produit dans chacune d’entre elles n’a pu que se réfugier dans le ballon. On peut donc quantifier le volume de gaz obtenu simplement en mesurant le diamètre d du ballon, et calculant le volume :
(7) ![]()
d) Le test du dioxyde de carbone
La dernière étape consiste à vérifier que c’est bien du dioxyde de carbone qui est produit. C’est très simple : il suffit de placer un ballon rempli de gaz sous le nez d’un courageux volontaire, et lui imposer le flux d’air sortant du ballon. Le dioxyde de carbone a en effet une propriété particulière : il vient chatouiller le nerf trigéminal, dans le nez, et cela provoque une douleur qui peut être aiguë, mais brève et sans conséquence !
Aller plus loin : tester l’acidité
On peut se servir de cette activité pour introduire le pH, qui est une quantification du niveau d’acidité d’une solution. Pour cela, des bandelettes de test sont disponibles par exemple dans les magasins d’articles de piscines, ou bien on choisira de faire un indicateur « maison », tel que le jus de cuisson du chou rouge, dont les couleurs bariolées font l’attrait. Une alternative est une infusion de thé noir, claire en milieu acide, bien plus sombre en milieu basique.